- Валентность и степень окисления
- Степень окисления. Бинарные соединения
- Урок 18. Химия 8 класс
- В данный момент вы не можете посмотреть или раздать видеоурок ученикам
- Получите невероятные возможности
- Конспект урока «Степень окисления. Бинарные соединения»
- § 18. Степень окисления
- Конспект урока химии в 8 классе на тему «Степень окисления», презентация к уроку
- Разработка урока по химии на тему «Степень окисления» 8 класс
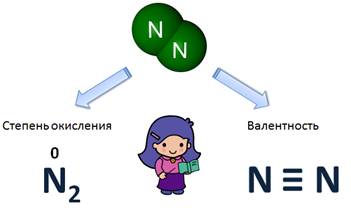
Валентность и степень окисления
Валентность
Определяют валентность по числу связей, которые один атом образует с другими. Для примера рассмотрим две молекулы
Для определения валентности нужно хорошо представлять графические формулы веществ. В этой статье вы увидите множество формул. Сообщаю вам также о химических элементах с постоянной валентностью, знать которые весьма полезно.
В электронной теории считается, что валентность связи определяется числом неспаренных (валентных) электронов в основном или возбужденном состоянии. Мы касались с вами темы валентных электронов и возбужденного состояния атома. На примере фосфора объединим эти две темы для полного понимания.
Подавляющее большинство химических элементов обладает непостоянным значением валентности. Переменная валентность характерна для меди, железа, фосфора, хрома, серы.
Степень окисления
Численно степень окисления равна условному заряду, который можно приписать атому, руководствуясь предположением, что все электроны, образующие связи, перешли к более электроотрицательному элементу.
Зная изменения электроотрицательности в периодах и группах периодической таблицы Д.И. Менделеева, можно сделать вывод о том какой элемент принимает «+», а какой минус. Помогают в этом вопросе и элементы с постоянной степенью окисления.
Самостоятельно определите степени окисления атомов в следующих веществах: RbOH, NaCl, BaO, NaClO3, SO2Cl2, KMnO4, Li2SO3, O2, NaH2PO4. Ниже вы найдете решение этой задачи.
Сравнивайте значение электроотрицательности по таблице Менделеева, и, конечно, пользуйтесь интуицией 🙂 Однако по мере изучения химии, точное знание степеней окисления должно заменить даже самую развитую интуицию 😉
© Беллевич Юрий Сергеевич 2018-2021
Данная статья написана Беллевичем Юрием Сергеевичем и является его интеллектуальной собственностью. Копирование, распространение (в том числе путем копирования на другие сайты и ресурсы в Интернете) или любое иное использование информации и объектов без предварительного согласия правообладателя преследуется по закону. Для получения материалов статьи и разрешения их использования, обратитесь, пожалуйста, к Беллевичу Юрию.
Блиц-опрос по теме Валентность и степень окисления
Степень окисления. Бинарные соединения
Урок 18. Химия 8 класс
В данный момент вы не можете посмотреть или раздать видеоурок ученикам
Чтобы получить доступ к этому и другим видеоурокам комплекта, вам нужно добавить его в личный кабинет, приобрев в каталоге.
Получите невероятные возможности
Конспект урока «Степень окисления. Бинарные соединения»
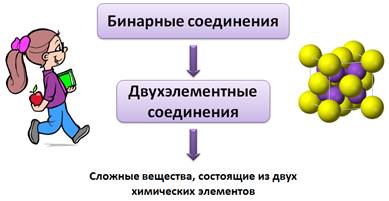
Бинарные соединения еще называют двухэлементными соединениями, потому что «би» от лат. – два. Т.е. бинарные соединения – это сложные вещества, состоящие из двух химических элементов.
Ковалентная полярная связь
Степень окисления – это условный заряд атомов химического элемента в соединении, если предположить, что оно состоит только из ионов.
Степень окисления может быть положительной, отрицательной и нулевой. Положительную степень окисления имеют как металлы, так и неметаллы, кроме фтора, гелия и неона. Максимальная степень окисления равна номеру группы. Т.е. у N высшая степень окисления равна +5, т.к. он находится в V группе. Отрицательную степень окисления имеют только неметаллы, т.к. они присоединяют электроны до завершения внешнего уровня. Минимальная степень окисления равна № группы – 8. Т.о. у N минимальная степень окисления будет 5 – 8 = –3. Кроме максимальной и минимальной степени окисления есть еще промежуточная степень окисления. Например, у N она равна +3.
Степень окисления F всегда –1, потому что он самый электроотрицательный элемент и принимает электроны при образовании химической связи. Например, в соединении NaF, у F степень окисления (–1).
У кислорода степень окисления –2, потому что он второй элемент по электроотрицательности, исключение cоставляет соединение кислорода с фтором, где его степень окисления +2. Например, в соединении CaO, степень окисления О (–2), а в соединении OF2, степень окисления О (+2).
У металлов степень окисления всегда положительная, т.к. они отдают электроны другим атомам. Степень окисления металлов А групп численно совпадает с валентностью. Например, в соединении Na2O степень окисления Na (+1), т.к. он является металлом, значит, у него только положительная степень окисления, а 1, потому что он является металлом I A группы, значит, и валентность его – единица. Аналогично и в соединении BaS, степень окисления Ва (+2), т.к. он металл II A группы, в соединении Al2O3, степень окисления Al (+3), т.к. это металл III А группы.
Степень окисления Н всегда (+1), за исключением его соединений с металлами, где у него степень окисления (–1). Например, CaH2, KH, LiH, в этих соединениях у водорода степень окисления (–1).
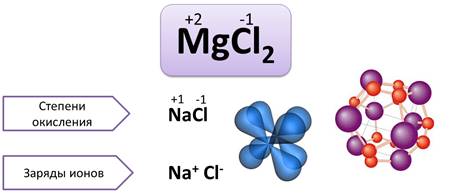
Как было сказано, валентность численно совпадает со степенью окисления. Однако не всегда. Степень окисления имеет знак заряда, а валентность – нет.
Валентность – это число связей, которыми атом связан с другими атомами, а степень окисления – это условный заряд атомов.
Сравним валентность и степень окисления у азота (N2). Степень окисления равна 0, т.к. это простое вещество, а вот валентность равна III, потому что атом азота связан с другим атомом азота тройной связью.
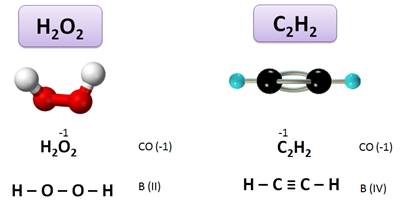
Или в пероксиде (Н2О2) степень окисления О (–1), а валентность равна II, т.к. О связан двумя связями с атомами водорода: Н – О – О – Н.
А в ацетилене (С2Н2) степень окисления С (–1), а валентность IV:
Учитывая, что суммарная степень окисления равна 0, можно найти степени окисления элементов в соединении, а также составить формулу соединения, зная степени окисления.
Определим степени окисления элементов в соединении Fe2O3. Степень окисления О нам известна (–2). Следовательно, три атома О будут иметь общий заряд (–6), т.к. (–2) · 3 = –6. Тогда общий заряд двух атомов железа будет равен (+6), помните, что суммарный заряд равен 0. Значит, степень окисления одного атома Fe будет (+3), т.к. (+6) ׃ 2 = +3.
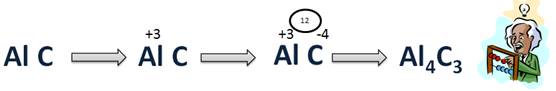
Составим формулу соединения Al с C. Для этого запишем символы элементов Al, C. Углерод на втором месте, потому что он более электроотрицательный. Al – элемент III A группы. Он является металлом, поэтому он отдаст свои 3 электрона и получит степень окисления (+3), а С – элемент IV A, он примет еще 4 электрона для завершения своего внешнего уровня, на котором уже есть 4 электрона, при этом получит степень окисления (–4). Запишем значения степеней окисления в формулу сверху. Теперь найдем наименьшее общее кратное. Оно будет 12. Затем НОК разделим на абсолютные значения степеней окисления и получим соответствующие индексы. 12 : 3 = 4, значит индекс у Al – 4, 12 : 4 = 3, значит индекс у С – 3. Следовательно, формула будет Al4C3.
Чтобы дать название бинарному соединению нужно сделать следующим образом: сначала называют более электроотрицательный элемент – это неметалл. Его латинское название стоит в именительном падеже и употребляется с суффиксом – ид. Например: оксид, хлорид, сульфид, нитрид. Второе слово обозначает элемент менее электроотрицательный, его название стоит в родительном падеже.
Na2S – сульфид натрия, K2O – оксид калия, BaCl2 – хлорид бария, Mg3N2 – нитрид магния. Если элемент имеет переменную степень окисления, то после названия в скобках римскими цифрами указывают степень окисления. Например, назовём следующие соединения: MnO2, CO2, P2O5.
Название бинарного соединения
В некоторых случаях, число атомов элементов обозначают при помощи названий числительных на греческом языке. Т.е. 1 – моно, 2 – ди, 3 – три, 4 – тетра, 5 – пента и т.д. Например, СО – монооксид углерода, или оксид углерода (II); СО2 – диоксид углерода, или оксид углерода (IV).
Для того чтобы химики всего мира понимали друг друга, необходимо было создать единую терминологию и номенклатуру, т.е. названия веществ. Впервые в 1785 г. такими учеными, как А. Лавуазье, А. Фуркруа, Л. Гитоном де Мерво и К. Бертолле, были разработаны принципы номенклатуры. В настоящее время принципы номенклатуры и терминологии разрабатывает Международный союз теоретической и прикладной химии (ИЮПАК).
§ 18. Степень окисления
При изучении ионной и ковалентной полярной химических связей вы знакомились со сложными веществами, состоящими из двух химических элементов. Такие вещества называют бинарными (от лат. би — два) или двухэлементными.
Вспомним типичные бинарные соединения, которые мы приводили в качестве примера для рассмотрения механизмов образования ионной и ковалентной полярной химической связи: NaCl — хлорид натрия и НСl — хлороводород.
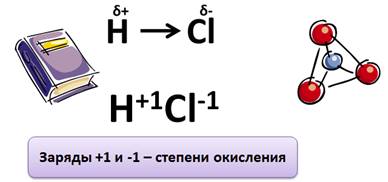
В молекуле же хлороводорода НС1 химическая связь образуется за счёт спаривания неспаренных внешних электронов и образования общей электронной пары атомов водорода и хлора:
Правильнее представлять образование ковалентной связи в молекуле хлороводорода как перекрывание одноэлектронного s-облака атома водорода с одноэлектронным р-облаком атома хлора:
Степень окисления — это условный заряд атомов химического элемента в соединении, вычисленный на основе предположения, что все соединения (и ионные, и ковалентно-полярные) состоят только из ионов.
Степень окисления может иметь отрицательное, положительное или нулевое значения, которые обычно ставятся над символом элемента сверху, например:
Отрицательное значение степени окисления имеют те атомы, которые приняли электроны от других атомов или к которым смещены общие электронные пары, т. е. атомы более электроотрицательных элементов. Фтор всегда имеет степень окисления —1 во всех соединениях. Кислород, второй после фтора по значению электроотрицательности элемент, почти всегда имеет степень окисления —2, кроме соединений со фтором, например:
Положительное значение степени окисления имеют те атомы, которые отдают свои электроны другим атомам или от которых оттянуты общие электронные пары, т. е. атомы менее электроотрицательных элементов. Металлы в соединениях всегда имеют положительную степень окисления. У металлов главных подгрупп: I группы (IA группы) во всех соединениях степень окисления равна +1, II группы (IIA группы) равна +2, III группы (IIIA группы) — +3, например:
В большинстве соединений атомы водорода имеют степень окисления +1, например:
Нулевое значение степени окисления имеют атомы в молекулах простых веществ и атомы в свободном состоянии, например:
К понятию «степень окисления» близко понятие «валентность», с которым вы знакомились, рассматривая ковалентную химическую связь. Однако это не одно и то же.
Понятие «валентность» применимо для веществ, имеющих молекулярное строение. Подавляющее большинство органических веществ, с которыми вы будете знакомиться в 10 классе, имеет именно такое строение. В курсе основной школы вы изучаете неорганическую химию, предметом которой являются вещества как молекулярного, так и немолекулярного, например ионного, строения. Поэтому предпочтительнее использовать понятие «степень окисления».
Чем же отличается валентность от степени окисления?
Часто валентность и степень окисления численно совпадают, но валентность не имеет знака заряда, а степень окисления — имеет. Например, одновалентный водород имеет следующие степени окисления в различных веществах:
Казалось бы, что одновалентный фтор — самый электроотрицательный элемент — должен иметь полное совпадение значений степени окисления и валентности. Ведь его атом способен образовывать лишь одну-единственную ковалентную связь, так как ему недостаёт до завершения внешнего электронного слоя одного электрона. Однако и здесь наблюдается различие:

В соединениях суммарная степень окисления всегда равна нулю. Зная это и степень окисления одного из элементов, можно найти степень окисления другого элемента по формуле, например бинарного соединения. Так, найдём степень окисления хлора в соединении С12O7.

Нетрудно заметить, что аналогично вы работали с понятием «валентность», когда выводили формулу ковалентного соединения или определяли валентность элемента по формуле его соединения.
Например: NaCl — хлорид натрия, MgS — сульфид магния, КН — гидрид калия, СаО — оксид кальция. Если же электроположительный элемент проявляет разные степени окисления, то это отражают в названии, обозначив степень окисления римской цифрой, которую ставят в конце названия, например: 

В некоторых случаях число атомов элементов обозначают при помощи названий числительных на греческом языке — моно, ди, три, тетра, пента, гекса и т. д. Например: 


Чтобы химики разных стран понимали друг друга, потребовалось создание единой терминологии и номенклатуры веществ. Принципы химической номенклатуры были впервые разработаны французскими химиками А. Лавуазье, А. Фуркруа, Л. Гитоном де Мерво и К. Бертолле в 1785 г. В настоящее время Международный союз теоретической и прикладной химии (ИЮПАК) координирует деятельность учёных разных стран и издаёт рекомендации по номенклатуре веществ и терминологии, используемой в химии.
Конспект урока химии в 8 классе на тему «Степень окисления», презентация к уроку
Ищем педагогов в команду «Инфоурок»
Выбранный для просмотра документ конспект открытого урока степень окисления.docx
открытого урока химии
Образовательные: сформировать знания учащихся о степени окисления, дать представления о бинарных соединениях, научить комментировать слайды и работать с компьютерными схемами. Продолжить формирование умений работать самостоятельно с учебником, тетрадью, тестами.
Развивающие: развивать наблюдательность, память при просмотре компьютерной презентации. Развивать умение сравнивать, прогнозировать, обобщать и делать выводы. Развивать информационную культуру учащихся.
Воспитательные: способствовать формированию интереса к знаниям, умениям, адекватной оценке своей деятельности.
I. Организационный момент.
II.Изучение нового материала.
1.Сообщение темы и целей урока.
1 )Понятие о степени окисления.
-определите заряды атомов в соединениях.
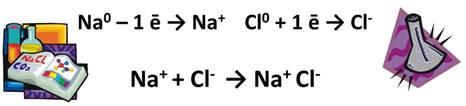
*Если в случае ионных соединений NаС1 происходит отрыв электронов от атома металла и его присоединение к атому металла и образуются ионы, то в случае НС1 происходит лишь смещение их электронов в сторону более электроотрицательного элемента.
-представите, что и в молекуле НС1 электрон, полностью перешел к атому хлора, тогда какие бы заряды приобрели атомы этих элементов?
*заряды в этом случае были +1 и —1: Н + СГ.
такие условные заряды называют степенью окисления.
Слайд 3 Степень окисления — это условный заряд атомов химического элемента в соединении, вычисленный на основе предположения, что все соединения (ионные и ковалентно-полярные) состоят только из ионов.
-степень окисления может иметь положительное, отрицательное и нулевое значения.
-как по формулам химических соединений, рассчитать с. о.?
Слайд 4-5 *Для этого надо знать определенные правила.
1. В соединениях отрицательное значение с. о. имеют элементы с большим значением электроотрицательности, а положительное значение с.о. элементы с меньшим значением электроотрицательности.
2. Есть элементы с постоянной с. о. и элементы с переменной с. о.
Элементы с постоянным значением с. о.: а) Металлы всегда имеют положительное значение с. о. У металлов главных подгрупп: I группы во всех соединениях с. о. равна +1.
IIгруппы + 2, IIIгруппы +3
б) фтор в соединениях всегда имеет с. о.—1.
Элементы с переменным значением с. о.:
а)Все остальные металлы (кроме перечисленных выше металлов)
б)Почт вес неметаллы.
в)Кислород почти всегда имеет с. о. —2.
г)Вбольщинстве соединений водород имеет с. о. +1, но в соединениях с металлами заряжен отрицательно, с. о. равна —1.
3. нулевое значение с. о. имеют атомы в молекулах простых веществ в атомы в свободном состоянии.
Слайд 6 2).Вычисление степени окисления элемен по формуле вещества.
-составим алгебраическое уравнение с одним неизвестным для определения значения с. о. в каком-либо соединении:
— Определите степень окисления в сложных соединениях
Слайд 8 3) с оставление химических формул по степени окисления
-находим наименьшее общее кратное-12
-расчытываем степень окисления.12\3=4, 12\4=3
4 )П ервоначальные представления о номенклатуре бинарных соединений.
Бинарные соединения – соединения, состоящие из 2 элементов.
Вначале пишут элементы с положительным значением с. о., затем с отрицательным.
Названия соединений даются в обратном порядке: вначале произносят название элемента с отрицательной с. о. добавляя суффикс — ид, после этого название элемента с положительной с. о.в родительном падеже. Если элемент имеет переменную с. о., то она указывается в названии (римскими цифрами в скобках).
NаС1 — хлорид_натрия; К 2 S — сульфид калия. )
Нахождение с.о. и составление формул:
составить формулы: оксидов азота (III), (V), нитридов: калия, кальция, бора;
хлоридов: марганца (II), (IV), фосфора (III), (V).
Слайд 9 IV. Домашнее задание: § 17. упр. 1,5
Разработка урока по химии на тему «Степень окисления» 8 класс
Ищем педагогов в команду «Инфоурок»
КГУ « Средняя школа с. Танбалытас с ДМЦ»
Разработка открытого урока по химии 8 класс
Провела: учитель химии
Тема: Степень окисления химических элементов. Определение степени окисления по формулам соединений. Бинарные соединения водорода.
1. Продолжить изучение валентности. Дать понятие степени окисления. Рассмотреть виды степеней окисления: положительная, отрицательная, нулевое значение. Сформировать умения определять степени окисления химических элементов по формулам, составлять формулы соединений по степеням окисления химических элементов.
2. Развивать память, логическое мышление, внимание через сравнения, обобщения, выделение главного при изучении нового материала. Продолжить развитие навыков самостоятельной работы.
3. Воспитание интереса к химии как науке. Формировать чувство толерантности (терпимости и уважения к чужому мнению), взаимопомощи
Ожидаемые результаты обучения:
Знать определения: c тепень окисления, окислительно-восстановительная реакция, окислитель, восстановитель, процесс окисления и процесс восстановления.
Уметь: определять С.О. по формуле и составлять формулы по известной С.О.
презентация “Окислительно-восстановительные реакции» (при разработке презентации использовались материалы из Интернета);
инструкции «Правила для определения степеней окисления химических элементов», « Алгоритм составления формул в соединениях »;
карточки для закрепления;
периодическая система Д.И.Менделеева.
Тип урока: Урок усвоения новых знаний
Повторение по теме «Строение атома по положению в ПС ХЭ. Химические связи»-10мин
Изучение нового материала-16мин.
Закрепление изученного материала-13мин.
Ход урока: I . Организационно-мотивационная часть
по теме «Строение атома по положению в ПС ХЭ. Химические связи»
1) фронтальный опрос
Что называется химической связью?
Какие виды химических связей вы знаете?
Какая связь называется ковалентной связью?
Какие ковалентные связи выделяют?
Что такое валентность?
Как мы определяем валентность?
Какие элементы (металлы и неметаллы) имеют переменную валентность?
2) Повторение строения атома (методом незаконченных предложений)
1 . Атом имеет заряд ядра (+) (равный порядковому номеру)
2. Вокруг ядра вращаются электроны
3. Заряд электронов отрицательный
4.Число электронов в атоме равно порядковому номеру
5. Количество электронных
уровней равно номеру периода
6. Количество электронов на
последнем уровне в атомах
главных подгрупп равно номеру группы
Дифференцированные задания для групп:
* 1. Составить электронную и электронно-ячеечную формулу атома фосфора по положению в периодической системе химических элементов.
2. Определить количество валентных электронов
1. Определить положение элемента в таблице (порядковый номер, период, группа). Вспомнить, каков физический смысл каждого из этих понятий.
Например: О №8 – это заряд ядра и общее число электронов,
группа – 6 (главная) – это число электронов на последнем уровне
2. Возле знака элемента поставить заряд ядра (слева внизу от знака), зарисовать дуги электронных орбиталей и возле каждой дуги поставить количество эектронов.
3. Составить электронную формулу элемента.
1 s 2 | 2 s 2 2 p 4
4. Составить электронно-ячеечную формулу элемента.
1 s 2 | 2 s 2 2 p 4
5. Определить количество валентных электронов – 6 (электроны последнего уровня)
**1. Составить электронную и электронно-ячеечную формулу атома фосфора по положению в периодической системе химических элементов.
2. Определить количество валентных электронов
1. Определить положение фосфора в таблице (порядковый номер, период, группа). Вспомнить, каков физический смысл каждого из этих понятий.
2. Возле знака элемента поставить заряд ядра (слева внизу от знака), зарисовать дуги электронных орбиталей и возле каждой дуги поставить количество электронов.
3. Составить электронную формулу элемента.
4. Составить электронно-ячеечную формулу элемента.
5. Определить количество валентных электронов
*** 1. Составить электронную и электронно-ячеечную формулу атома фосфора по положению в периодической системе химических элементов.
2. Определить количество валентных электронов
. Как вы думаете в каких из этих соединений будут наблюдаться заряды на атомах.
У водорода H 2 заряда на атомах не наблюдается , т.к. связь ковалентная неполярная и общая пара не смещена ни к одному из атомов, а в равной степени принадлежит обоим атомам. У кальция Са 0 также зарядов на атомах не наблюдается, т.к. в целом атомы электронейтральные частицы.
Заряды на атомах наблюдаются только в случае соединений с ионной связи и ковалентной полярной: Na + Cl — , HCl . Если в случае ионных соединений происходит отрыв электронов от атома металла и его присоединение к атому неметалла и образуются ионы, то в случае НС l происходит лишь частичное смещение общих электронов в строну более электроотрицательного элемента. Представим, что в молекуле HCl электрон полностью перешел к хлору, тогда какие бы заряды приобрели атомы этих элементов?
Процесс отдачи электронов, сопровождающийся повышением степени окисления, называется окислением.
Процесс присоединения электронов, сопровождающийся понижением степени окисления, называется восстановлением.
Атом, который отдает электроны и увеличивает свою степень окисления, т.е. окисляется, называется восстановителем.
Атом, который присоединяет электроны и уменьшает свою степень окисления, т.е. восстанавливается, называется окислителем.
«Окислитель как отъявленный злодей
Как пират, бандит, агрессор, Бармалей
Потерпев урон, восстановитель
Восклицает: «Вот я, помогите!
Электроны мне мои верните!»
Но никто не помогает и ущерб
Напишите образование ионов магния и азота:
Такие условные заряды называют степенью окисления.
Степень окисления — это условный заряд атомов химического элемента в соединении, вычисленный на основе предположения, что все соединения ( ионные и ковалентно-полярные) состоят только из ионов.
Виды степеней окисления:
Значение степени окисления:
Для определения степени окисления атома в соединении следует учитывать ряд положений:
1. В соединениях отрицательное значение с.о. имеют элементы с
большим значением электроотрицательности, а положительное значение с.о.- элементы с меньшим значением электроотрицательности.
2.Есть элементы с постоянной степенью с.о. и с переменной с. о.
Элементы с постоянным значением с. о.:
А) Металлы всегда имеют положительное значение С.О..У металлов главных подгрупп: 1 группы во всех соединениях с.о. равна +1; 2группы-+2; 3 группы-+3
Элементы с переменным значением с.о.:
А) все остальные металлы (кроме перечисленных выше)
Б) Почти все неметаллы
В) Кислород почти всегда имеет с. о. равно-2
3. Нулевое значение с.о. окисления имеют атомы в молекулах простых веществ и атомы в свободном состоянии.
4. В соединениях суммарное значение с.о. равно нулю.
5. Для того, чтобы рассчитать с.о. данного элемента в соединении, надо знать с.о. другого элемента
Определите степень окисления элементов в соединениях:
Определите степень окисления элементов в соединениях:
*1. Определить степень окисления того элемента, в которой мы уверены.
3. Найти заряд атома другого элемента: +6 : 2 =+3
Определите степень окисления элементов в соединениях:
** 1. Определить степень окисления того элемента, в которой мы уверены.
2. Найти общий отрицательный заряд для этого элемента.
3. Найти заряд атома другого элемента.
4. Поставить степень окисления этому элементу.
Определите степень окисления элементов в соединениях:
Алгоритм составления формулы в соединениях:
5. Разделить наименьшее общее кратное на значение степеней окисления и полученные индексы приписать внизу справа после символа соответствующего элемента.
6. Если степень окисления четное – нечетное, то они становятся рядом с символом справа внизу крест – накрест без знака «+» и «-»:
7. Если степень окисления имеет четное значение, то их сначала нужно сократить на наименьшее значение степени окисления и поставить крест – накрест без знака «+» и «-»: С +4 О -2
Закрепление: Составьте формулы соединений элементов K Mg AL с
— кислородом (на доске)
— серой ( II ) (самостоятельно в парах)
Правила игры: учитель раздает карточки. На каждой карточке написан один вопрос и один ответ на другой вопрос.
Учитель начинает игру. Зачитает вопрос, ученик, у которого на карточке есть, ответ на мой вопрос поднимает руку и говорит ответ. Если ответ правильный, то он читает свой вопрос и у того ученика у которого есть ответ на этот вопрос поднимает руку и отвечает и т.д. Образуется змейка правильных ответов.
1.Как и где обозначается степень окисления у атома химического элемента?
Ответ : промежуточная
2.Какие виды степеней окисления выделяют у атомов химических элементов?
Ответ : арабской цифрой над символом элемента с зарядом «+» и «-».
3.Какую степень проявляет металлы?
Ответ : положительная, отрицательная, нулевая.
4.Какую степень проявляют простые вещества или молекулы с неполярной ковалентной связью.
Ответ : положительная
5.Какой заряд имеют катионы и анионы?
Ответ : нулевое.
6.Как называется степень окисления, которая стоит между положительным и отрицательным степенями окисления.
Ответ : положительный, отрицательный
V . Рефлексия. Подведение итогов урока. Какие вопросы сегодня были рассмотрены на уроке?
Я понимал всё, о чём говорилось и, что делалось на
уроке. Я принимал активное участие в работе группы.
Мне было интересно.
Мне было достаточно комфортно на уроке, но я
принимал в нём не очень активное участие. Мне
было не очень интересно.
Домашнее задание я не понял. К ответам на уроке
я был не готов. Мне было скучно на уроке.
VI . Домашнее задание: §66, упр 3,4.